|
医疗器械警戒快讯 2023年第8期(总第198期)
发布日期:2023-08-24
美国FDA发布关于Abbott公司召回Amplatzer可操控输送导管的警示信息 发布日期:2023年7月26日 召回级别: I级,是最严重的召回类型,使用这些器械可能造成严重伤害或者死亡。 召回产品: ● 产品名称:Amplatzer可操控输送导管 ● 产品代码:ASDS-14F-075 ● 分销日期:2022年10月4日至2023年2月22日 ● 在美国召回数量:672 ● 召回发起日期:2023年6月12日。 产品用途: Abbott 公司Amplatzer可操控输送导管是一种插入皮肤的心脏导管,它为基于导管的设备引入心室提供了一条通道,专门用于输送Amplatzer Amulet左心耳封堵器。 召回原因: Abbott公司正在召回Amplatzer可操控输送导管,因为使用该装置进行手术的患者体内出现气泡(空气栓塞)的风险增加。空气栓塞可导致心脏血流量突然减少、心动过速或者心动过缓、低血压和血液中缺乏足够的氧气等损伤。空气栓塞也可能导致严重的健康后果,包括中风和死亡。 截止目前,Abbott公司报告了26起与此次召回产品有关的事件,其中16例伤害报告,尚无死亡报告。 受影响人群: ● 使用Abbott公司可操控输送导管进行心导管插入术的患者。 ● 计划使用Abbott公司可操控输送导管进行心导管插入术的医务人员。 采取措施: 2023年6月12日,Abbott公司向客户发布了医疗器械召回通知,提供了以下建议措施: ● 将任何剩余未使用的Amplatzer可操控输送导管退还给Abbott公司。Abbott公司代表可以协助归还这些设备。 ● 未来Amplatzer Amulet左心耳封堵器植入时可以使用 Amplatzer TorqVue? 45°x45°输送系统。 ● 填写通知所附的确认表并将其反馈给Abbott公司。 (美国FDA网站)
美国FDA发布关于GE HealthCare公司召回TruSignal传感器的警示信息 发布日期:2023年7月28日 召回级别:I级,是最严重的召回类型,使用这些器械可能造成严重伤害或者死亡。 召回产品 ● 产品名称: ● 分销日期:2021年1月1日至2023年5月4日 ● 在美国召回数量:7559 ● 召回发起日期:2023年5月19日 产品用途: TruSignal传感器通过在皮肤上放置传感器持续监控流经动脉的血液中的含氧量(动脉血氧饱和度或者SpO2)和脉搏率。这些传感器经过设计和测试,有助于确保患者血液中有足够的氧气来保持身体功能,并为医务人员提供信息以做出治疗决定。 召回原因: GE HealthCare公司正在召回有故障的TruSignal传感器,该传感器可能会在不通知医务人员的情况下,在除颤期间减少发送到心脏的能量,这可能会阻止在危急情况下提供生命救治。这个问题对于因心脏骤停而需要除颤的住院患者最为危险。受影响的传感器还可能无意中将患者暴露于其他来源的电流,或者可能提供不准确的SpO2测量值,从而影响治疗决策。 使用有缺陷的TruSignal SpO2传感器可能会导致严重伤害或者死亡。GE HealthCare公司尚未收到任何关于此问题的伤亡报告。 受影响人群: ● 使用TruSignal SpO2传感器持续监测其SpO2和脉搏率的成人和儿童。 ● 使用TruSignal SpO2传感器监控成人和儿童患者的医务人员。 采取措施: 2023年5月19日,GE HealthCare公司向受影响的客户发送了一份紧急医疗器械纠正通知,建议采取以下措施: ● 使用替代的方法监测SpO2数值,包括未受影响的TruSignal传感器或者备用SpO2设备。 ● 如果没有可使用的替代方法,只要受影响的TruSignal SpO2传感器没有被液体浸透,仍可以使用。 ● 使用受影响的TruSignal SpO2传感器时,如果需要除颤,请遵循以下说明: ● 使用前,确认成人/儿童SpO2传感器没有覆盖发射器或者检测器的材料。 ● 如果发现有其他物质,丢弃该传感器并使用另一个传感器。 ● 确保所有潜在用户了解此安全通知和建议的措施,并保留此通知。 ● 完成通知所附的确认表,并发送至:Recall.39004@ge.com。 (美国FDA网站)
美国FDA发布关于Baxter Healthcare公司召回SIGMA Spectrum输液泵和Spectrum IQ输液系统的警示信息 发布日期:2023年8月1日 召回级别:I级,是最严重的召回类型,使用这些器械可能造成严重伤害或者死亡。 召回产品 ● 产品名称:SIGMA Spectrum输液泵(带第8版Master Drug Library),Spectrum IQ输液系统(带第9版Dose IQ安全软件) ● 产品编号:35700BAX2和3570009 ● 分销日期:2015年9月29日至2023年5月2日 ● 在美国召回数量:22769 ● 召回发起日期:2023年6月15日 产品用途: SIGMA Spectrum输液泵(带第8版Master Drug Library)和Spectrum IQ输液系统(带第9版Dose IQ安全软件)是软件控制的输液泵,可输送定量的液体,如药物、血液和血液制品以及其他治疗所需要的液体。液体通过注入静脉或其他畅通的途径进入身体。这些输液泵用于医院和其他医疗保健服务机构。 召回原因: 由于输液泵软件分别升级到版本v8.01.01和v9.02.01后,上游堵塞的错误报警事件增加,Baxter Healthcare公司正在召回SIGMA Spectrum输液泵(带第8版Master Drug Library)和Spectrum IQ输液系统(带第9版Dose IQ安全软件)。 错误的上游阻塞报警导致治疗中断或者延迟,并导致临床医生劳累,这可能导致严重的不良健康后果,尤其是对接受维持生命药物治疗的人。使用这些产品可能会导致严重伤害或者死亡。 Baxter Healthcare公司报告了131起投诉,3份严重伤害报告,没有与此问题相关的死亡报告。 受影响人群: ● 使用SIGMA Spectrum输液泵(带第8版Master Drug Library)和Spectrum IQ输液系统(带第9版Dose IQ安全软件)的医务人员 ● 使用SIGMA Spectrum输液泵(带第8版Master Drug Library)和Spectrum IQ输液系统(带第9版Dose IQ安全软件)的患者 采取措施: 2023年6月15日,Baxter Healthcare公司向受影响的客户发送了一封紧急医疗器械纠正函,其中包含软件版本为v8.01.01或者v9.02.01输液泵相关的建议: ● 按照屏幕上的说明或操作手册中的输注设置说明继续使用Spectrum V8和Spectrum IQ输液泵。说明书相关部分包括: ●注意,错误的上游阻塞报警可能以更高的比率出现,直到软件恢复完成。如果无法解决上游阻塞报警,请卸载并重新安装软件。 ● 使用随附的回复表格说明中列出的帐号登录门户网站,回复确认收到通知(即使没有任何剩余库存) https://BaxterFieldActionCustomerPortal.onprocess.com ● 向收到分销产品的使用单位或者部门转发通知副本。 通知中还提到,Baxter Healthcare公司代表将联系使用单位以确定纠正计划,并免费安排将所有受影响泵的软件恢复为之前的软件版本,即v8.01.00或v9.02.00。该代表将帮助使用单位确定受影响的序列号列表。 此次召回的v8.01.01和v9.02.01版本软件是为了解决之前涉及I级召回的v8.01.00和v9.02.00版本软件而创建的,旧版本存在输液泵对重复的上游堵塞事件不发出报警的风险。 ● 如果正在使用的输液泵的软件版本为v8.01.01或v9.02.01,则应遵循上述建议。 ● 如果正在使用的输液泵的软件版本为v8.01.00或v9.02.00(由于版本恢复或软件未从v8.01.00或v9.02.00更新),应该参考公司之前由于输液泵对重复的上游堵塞事件不发出报警而发起的I类召回中的建议。相关建议在FDA网站上也可以找到。 公司正在努力解决软件版本v8.01.01和v9.02.01中出现的重复上游堵塞报警问题。在实施解决方案之前,应遵循与此软件版本相关的所有建议。 (美国FDA网站)
澳大利亚TGA发布关于Smiths Medical公司召回Medfusion 3500/4000注射输液泵的警示信息 发布日期:2023年8月8日 召回级别:Ⅰ级,使用这些器械可能造成严重伤害或者死亡。 召回产品:Medfusion 3500/4000注射输液泵,该产品已不再供应,ARTG已注销。 召回原因: 用于检测闭塞性的力传感器的校准可能随着时间的推移出现偏移。尽管任何设备的力传感器校准都可能随着时间的推移而发生偏移,但据报道,2022年4月之前生产的设备由于柱塞头组件之间的机械干扰,这种偏移的可能性在增加。 召回行动: Smiths Medical公司已采取产品缺陷纠正行动。 ● 给临床医生建议:如果泵显示系统故障警报,关闭泵,然后重新打开。如果警报持续存在,请停止泵的使用,并使用备用泵。 ● 给生物医学工程师建议:如果在过去12个月内未进行年度维护,建议进行年度维护测试,并确保使用最新版本的技术服务手册,遵循提供给受影响客户的信函中包含的详细说明。如果无法完成校准,Smiths Medical公司将提供免费更换柱塞头服务。 (澳大利亚TGA网站)
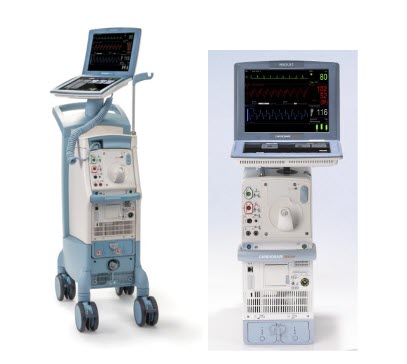
美国FDA发布关于Datascope/Maquet/Getinge公司召回Cardiosave Hybrid和Rescue主动脉内球囊泵(IABPs)的警示信息 发布日期:2023年8月10日 召回级别:I级,是最严重的召回类型,使用这些器械可能造成严重伤害或者死亡。 召回产品 ● 产品名称:Cardiosave Hybrid主动脉内球囊泵(IABP)和Cardiosave Rescue主动脉内球囊泵(IABP) ● 产品型号:Cardiosave Hybrid, Cardiosave Rescue ● 分销日期:2012年3月6日至2023年5月19日 ● 在美国召回设备:4586台 ● 召回发起日期:2023年6月5日 产品用途: Cardiosave Hybrid主动脉内球囊泵(IABP)和Cardiosave Rescue IABP是一个机电系统,用于主动脉内球囊的充放气。这些系统通过反搏为左心室提供临时支持。一旦球囊被定位在主动脉中,泵被设置为与心电图或者动脉压力波形同步工作,以使球囊在心动周期中的正确时间膨胀和收缩。 Cardiosave主动脉内球囊泵适用于急性冠状动脉综合征、心脏和非心脏手术,或者成人心力衰竭并发症。
召回原因: Datascope/Maquet/Getinge公司正在召回Cardiosave Hybrid和Rescue主动脉内球囊泵(IABPs),因为它们可能会因电源管理板或者螺线管板(电源路径)的电气故障而意外关闭。使用受影响的泵可能会导致严重的不良事件,包括引起血压不稳定、受伤和死亡。 Datascope/Maquet/Getinge公司报告了26起相关投诉。目前还没有伤亡报告。 受影响人群: ● 使用Cardiosave Hybrid或Rescue IABP接受血液循环支持的人 ● 使用Cardiosave Hybrid或Rescue IABP提供护理服务的医务人员 采取措施: 2023年6月5日,Datascope/Maquet/Getinge公司向所有受影响的客户发送了一份重要医疗器械建议函,要求客户采取以下控制措施: ● 确保有替代的IABP可以维持继续治疗。 ● 如果没有其他继续进行反搏治疗的方法,提供替代的血液动力学支持。 (美国FDA网站)
美国FDA发布关于Philips公司召回Trilogy Evo,Evo O2,EV300和Evo Universal呼吸机的警示信息 发布日期:2023年8月14日 召回级别:I级,是最严重的召回类型,使用这些器械可能造成严重伤害或者死亡。 召回产品 ● 产品名称:Trilogy Evo,Trilogy Evo O2,Trilogy EV300,Trilogy Evo Universal ● 产品型号和序列号:参见医疗器械召回数据库网站信息 https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfres/res.cfm?id=199472 ● 分销日期:2019年3月26日至2023年3月22日 ● 在美国召回设备:73000台 ● 召回发起日期:2023年3月29日 产品用途: Trilogy Evo,Evo O2、EV300和Evo Universal呼吸机为需要机械通气的人提供持续气道正压(CPAP)和间歇性气道正压呼吸支持。它们适用于体重至少达到2.5kg的儿童及成人患者,用于医院和护理机构以及患者的非紧急运输。Trilogy EV300和Trilogy Evo也可用于家庭中需要机械通气的人。 召回原因: 在一些设备的空气通道中检测到环境中的灰尘和污垢后,Philips公司正在召回Trilogy Evo,Evo O2,EV300和Evo Universal呼吸机。长期暴露在灰尘和污垢等环境污染物中会导致积聚物堵塞通风口,并导致设备输送的气压或者风量/流量错误。如果呼吸机不能提供正确水平的呼吸支持,患者可能得不到足够的氧气(换气不足),并可能经历二氧化碳或者其他气体压力的积聚,这可能导致严重伤害或者死亡。 Philips公司已经收到了542例关于这个问题的报告,其中2例伤害报告,1例死亡报告。 受影响人群: ● 使用受影响的Trilogy Evo,Evo O2、EV300和Evo Universal呼吸机获得呼吸支持的人。 ● 使用Trilogy Evo,Evo O2,EV300和Evo Universal提供呼吸支持的医务人员和家庭护理人员。 采取措施: 2023年4月17日,Philips公司向受影响的客户和患者发送了一份重要产品通知,内容如下: 如何识别受影响的产品 ● 找到设备底部的部件编号,并根据通知中列出的受影响部件编号进行验证。
防止给患者带来风险而需要采取的措施: ● 防止碎屑堆积在机器流量传感器上:使用Philips公司认可的微粒过滤器,防止大部分空气中的气溶胶和微粒进入设备。现在这个过滤器是必需的。按照使用说明书更换机器和患者之间的过滤器。按照使用说明书使用进气过滤器。注意:安装微粒过滤器不需要改变治疗设置。 ● 检测治疗中的变化:根据通气模式设置适当的警报,例如低潮气量、低每分钟通气量、低吸气压力和高吸气压力。检查近端压力和外部流量传感器故障,警报也可以提醒用户注意到此问题,这些都是不可设置的警报。如果治疗时过滤器堵塞进气量减少,进气过滤器堵塞警报将鸣响。如果出现这种情况,用户必须冲洗进气过滤器并更换微粒过滤器。阅读任何警报说明,尤其是呼吸机需要维修或呼吸机不工作的情况下。如果问题无法解决,使用替代的呼吸机设备。确保呼吸机依赖患者可以使用替代的呼吸机设备,如备用呼吸机或者手动复苏器。 (美国FDA网站)
澳大利亚TGA发布关于Stryker公司召回HeartSine Samaritan公共场所除颤器PAK的警示信息 发布日期:2023年8月14日 召回级别:Ⅰ级,使用这些器械可能造成严重伤害或者死亡。 召回产品:HeartSine Samaritan公共场所除颤器PAK (PAD-PAK)(ARTG 338960),目录编号PAD-PAK-03。 产品批号:A3644, A3654, A3655, A3659, A3660, A3664, A3765, A3803, A3840,A3842, A3843, A3844, A3845, A3846, A3847, A3848, A3849, J0748, J0752, J0754,J0755, J0756 召回原因: Stryker公司已确定受影响的PAD-PAKs可能因电池过早耗尽而无法使用。如果需要使用,受影响的PAD-PAKs可能无法接通电源,这可能会妨碍设备分析患者状况或者提供正确治疗。 到目前为止,尚未收到此类不良事件报告。 召回行动: ● 分销商 ● 终端客户
(澳大利亚TGA网站)
|
|



 TruSignal成人儿科传感器
TruSignal成人儿科传感器  TruSignal AllFit传感器
TruSignal AllFit传感器  TruSignal敏感皮肤传感器
TruSignal敏感皮肤传感器  TruSignal Wrap传感器
TruSignal Wrap传感器  TruSignal耳部传感器
TruSignal耳部传感器  带GE连接器的TruSignal集成式耳部传感器
带GE连接器的TruSignal集成式耳部传感器  带Datex连接器的TruSignal集成式耳部传感器
带Datex连接器的TruSignal集成式耳部传感器  带Ohmeda连接器的TruSignal集成式耳部传感器
带Ohmeda连接器的TruSignal集成式耳部传感器  拆下受影响的TruSignal SpO2传感器
拆下受影响的TruSignal SpO2传感器  根据医院协议进行除颤
根据医院协议进行除颤  不再需要除颤后,重新连接受影响的TruSignal SpO2传感器
不再需要除颤后,重新连接受影响的TruSignal SpO2传感器  准备泵和输入阀设置
准备泵和输入阀设置  泵编程
泵编程 

 立即检查库存,以确定受影响的批号。
立即检查库存,以确定受影响的批号。  向客户发送包括后续行动的客户信函(由召回发起人提供给受影响的分销商),或者如果需要Stryker公司联系客户,则通知Stryker公司。
向客户发送包括后续行动的客户信函(由召回发起人提供给受影响的分销商),或者如果需要Stryker公司联系客户,则通知Stryker公司。  收到退货单后,Stryker公司将安排更换。
收到退货单后,Stryker公司将安排更换。  分销商应根据当地处置指南处理受影响的设备。
分销商应根据当地处置指南处理受影响的设备。  检查受影响的批次,并在退货单中提供这些批次信息。
检查受影响的批次,并在退货单中提供这些批次信息。  一旦Stryker公司收到反馈表,将提供替换设备。
一旦Stryker公司收到反馈表,将提供替换设备。  在此期间,客户应监控设备状态指示器,如果存在任何状态指示器问题立即通知Stryker公司,公司将尽快提供更换电池。
在此期间,客户应监控设备状态指示器,如果存在任何状态指示器问题立即通知Stryker公司,公司将尽快提供更换电池。  一旦收到替换品,按照当地处置指南处理受影响的设备。
一旦收到替换品,按照当地处置指南处理受影响的设备。 