|
医疗器械警戒快讯 2025年第9期(总第223期)
发布日期:2025-10-09
医疗器械警戒快讯
(总第223期)
内容提要 美国FDA发布关于Dexcom公司因软件设计错误问题召回连续血糖监测仪应用程序G7 APP和ONE+ APP的警示信息 美国FDA发布关于雅培公司TactiFlex磁电定位压力监测射频消融导管尖端脱落问题早期警示信息 美国FDA发布关于3M公司因标签问题对输血/输液加温系统进行修正的警示信息 美国FDA发布关于mo-Vis BVBA公司因固件错误问题对R-net操纵杆固件进行修正的警示信息 澳大利亚TGA发布关于Olympus公司因说明书更新召回支气管镜的警示信息
美国FDA发布关于Dexcom公司软件设计错误问题召回连续血糖监测仪应用程序G7 APP和ONE+ APP的警示信息
发布日期:2025年9月12日 召回级别:此次召回涉及通过软件更新纠正某些设备,不涉及将它们从使用单位或销售机构撤除。FDA已将此次召回确定为最严重的类型。如果您继续使用本设备而不进行纠正,可能会导致严重伤害或死亡。 召回产品: 产品名称: 受影响的App版本包括:版本为2.8.0或更早的Dexcom G7 Android、iOS、watchOS App,版本为1.4.0或更早的Dexcom ONE+ CGM Android、iOS App。 产品用途: Dexcom G7连续血糖监测(CGM)系统是一种实时、连续血糖监测设备,适用于2岁及以上人群的糖尿病管理。Dexcom G7 CGM通过Dexcom G7接收器或使用与Dexcom G7 CGM App(Android、iOS、watchOS)兼容的智能设备显示血糖读数、趋势、警告和通知。Dexcom G7 CGM系统还旨在与数字连接设备进行自主通信,包括自动胰岛素剂量(AID)系统。 Dexcom ONE+连续血糖监测系统(Dexcom ONE+)是一种血糖监测系统,适用于连续测量2岁及以上人群(包括孕妇)间质液中的葡萄糖。Dexcom ONE+通过Dexcom ONE+接收器或使用与Dexcom ONE+ CGM App(Android、iOS)兼容的智能设备显示血糖读数、趋势、警告和通知。Dexcom ONE+还有助于检测高血糖和低血糖发作,促进急性和长期治疗调整。Dexcom ONE+旨在供患者在家中和医疗机构中使用。 召回原因:
Dexcom正在纠正Dexcom G7 App和Dexcom ONE+ App,它们包含软件设计错误,当传感器的发射器遇到硬件/固件故障时,该错误会导致“Sensor Failed”警告消失。受影响的App会结束CGM传感器会话,在不警告用户的情况下停止报告血糖值并在屏幕上显示“Start Sensor”或“No active sensor”消息。 未能提醒用户发射器故障可能会导致用户长时间错过血糖数据、通知、警告和警报,这可能导致长期严重低血糖或高血糖发作的治疗延迟。 使用受影响的产品可能会导致严重的不良健康后果,包括低血糖/高血糖和死亡。目前还没有与此问题相关的受伤或死亡报告。 召回措施:
2025年7月24日,Dexcom向所有受影响的客户发送了紧急医疗器械更正通知,建议采取以下行动。 Dexcom G7 iOS/G7 Watch iOS/Android App version 2.8及更早版本用户: 立即更新您的App以继续使用: 1. 点击Update App跳转到App Store。 2. 安装最新的Dexcom G7 App版本。 3. 打开Dexcom G7 App。 Dexcom ONE+ iOS / Android App version 1.4及更早版本用户: 立即更新您的App以继续使用: 1. 点击Update App跳转到App Store。 2. 安装最新的Dexcom ONE+ App版本。 3. 打开Dexcom ONE+ App。 (美国FDA网站)
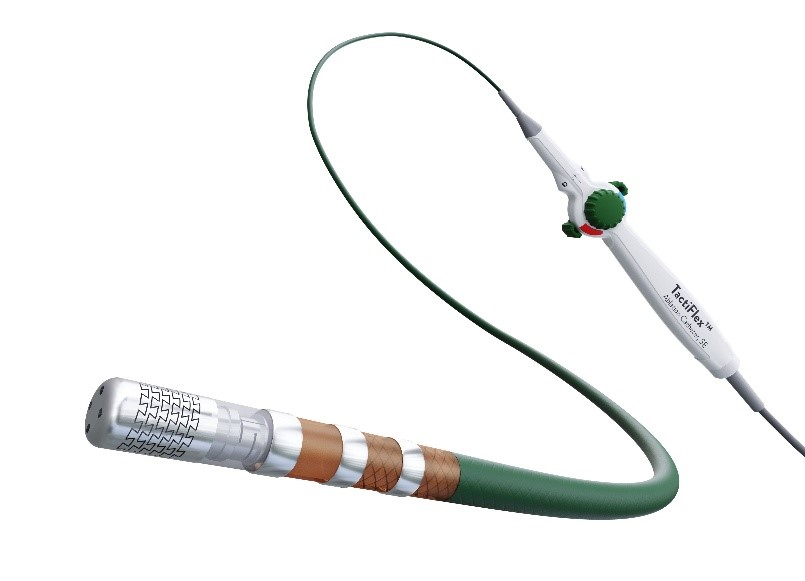
美国FDA发布关于雅培公司TactiFlex磁电定位压力监测射频消融导管尖端脱落问题早期警示信息
发布日期:2025年9月18日 召回级别:本通报是“加强医疗器械召回工作的沟通试点”(Communications Pilot to Enhance the Medical Device Recall Program)的措施之一。FDA已经意识到一个潜在的高风险问题。FDA将随时向公众通报有关情况,并在获得重要的新信息时更新此网页。 警示器械:TactiFlex磁电定位压力监测射频消融导管 雅培TactiFlex磁电定位压力监测射频消融导管与雅培的射频仪和三维心脏电生理标测系统配合使用,适用于心脏电生理标测和药物难治性、复发性、症状性、阵发性心房颤动或合并心房扑动的治疗。 UDI及产品编号参见FDA网站:
相关问题: 雅培已经发现,从包装中取出导管的过程中会发生尖端脱落事件。因为从包装中取出导管的操作不当可能会导致尖端损坏。虽然多数尖端损坏能够在导管插入患者之前通过检查发现,但最近报告的3份不良事件显示,损坏的尖端脱落在患者体内。这3份报告中都没有关于患者的不良健康后果进一步描述。对此,雅培改进了包装托盘的设计,以降低在导管取出过程中导致尖端损坏的可能性,并尽快开始部署新包装。 尖端脱落通常在使用前能够检测到,这种情况下,医生应更换导管。如果尖端在手术过程中脱落,则有可能导致栓塞或尖端在体内迁移,进一步可能导致呼吸系统受损、血流动力学不稳定、中风、缺血、心脏穿孔和/或血管损伤。截至9月11日,雅培尚未报告与此问题相关的任何严重伤害或死亡。 控制措施: 9月10日,雅培向所有受影响的客户发送了一封信,建议采取以下操作:
(美国FDA网站)
美国FDA发布关于3M公司因标签问题对输血/输液加温系统进行修正的警示信息
发布日期:2025年9月24日 召回级别:此次召回涉及更新设备使用说明,不涉及将其从使用或销售地点移除。FDA已将此次召回确定为最严重的类型。如果您不按照更新的说明继续使用此设备,可能会导致严重伤害或死亡。 召回产品:3M Ranger输血/输液加温高流量套件 3M Ranger输血/输液加温高流量套件,目录编号24355和24370,与3M Ranger 245型输血/输液加热装置一起使用; 3M Ranger输液加温冲洗套件目录编号24750,与3M Ranger 247型输液冲洗加温装置一起使用。 具体UDI及编号见FDA官网: 产品用途:Ranger 输血/输液加温系统是一种可在流速范围从 KVO(维持静脉通路的低流速)到 500 mL/分钟时对血液、血液制品和液体进行加温的医疗器械,根据输入条件将液体温度加热至 33°C 至 41°C。该系统由型号245加温装置(可安装在静脉输液(IV)支架上)和一次性无菌加温套件组成,加温套件有儿科型、标准型和高流量型三种配置。该系统必须仅由经过培训的医疗专业人员在临床环境中操作。 召回原因:3M公司正在对 Ranger 输血/输液加温系统(一种血液和血浆加温装置)进行纠正,原因是需要对标签进行修正。目前的标签未说明温度测量位置以及根据入口温度对应的流速。 Ranger 输血/输液加温系统的标示性能与实际能力存在差异。虽然该装置标签上标明可在 500 mL/分钟流速下输注液体并维持33°C–41°C的输出温度,但测试显示,加热器在高流速下无法充分加温液体。确认的规格显示,该装置仅能在显著较低流速下维持适宜温度: 如果在更新信息所示范围之外的流速下使用该装置,存在液体以较低温度输注的潜在风险。 使用受影响产品可能导致严重的不良健康后果,包括低体温和死亡。 目前尚未有与此问题相关的伤害或死亡报告。 召回措施: 请根据以下提供的最新信息,继续使用所示产品: 3M Ranger 输血/输液加温系统使用配备了编号24355和24370高流量套件的245型加热装置,,将血液、血液制品和液体从4°C-20°C的入口温度加热到33°C-41°C的输出温度。该系统根据入口温度提供可变流速:在4°C的入口温度下,流速可达167 mL/min的KVO,而在20°C(环境)的入口温度时,流速可达333 mL/min的KVO。该系统具有2分钟的预热时间至41°C,并包括43°C(超温)和33°C(欠温)的温度警报。 3M Ranger输液加温冲洗系统使用配备编号24750套件的247型加温装置,将冲洗液从20°C的入口温度加热到33°C-41°C的输出温度。该重力供给系统可提供高达580 mL/min的流速,并具有2分钟的预热时间至41°C。冲洗系统包括48°C(超温)和33°C(欠温)的温度警报。 4月21日,3M公司向所有受影响的客户发送了一份紧急医疗器械纠正通知,建议采取以下行动: 确保将此通知传达给机构内所有需要了解的人以及受影响产品转移到的任何部门。 根据提供的最新信息,继续使用所示产品。 请随身携带此通知,直到您收到更新的使用说明(IFU)和操作手册可用为止。 填写随附的客户确认表。 (美国FDA网站)
美国FDA发布关于mo-Vis BVBA公司因固件错误问题对R-net操纵杆固件进行修正的警示信息
发布日期:2025年9月16日 召回级别:此次召回涉及纠正某些器械,不涉及将其从使用或销售的地方移除。FDA已将此次召回确定为最严重的类型。如果您继续使用此设备而不进行纠正,可能会导致严重伤害或死亡。 召回产品: 产品名称: Micro Joystick R-net Multi Joystick R-net IDM-MICRO-R IDM-MULTI-R All-round Joystick R-net Light IDM-ARLITE-R. 这个问题影响所有配备mo-Vis R-net 2.3版本及以下固件的操纵杆。
产品用途: movis R-net操纵杆是比例式操纵杆,旨在支持电动轮椅用户控制轮椅。 该操纵杆将安装在电动轮椅上,为患者提供替代电动轮椅操纵杆的驱动选择。将操纵杆插入轮椅的控制箱中,使其能够控制电动轮椅。 召回原因: Mo-Vis BVBA正在纠正他们的R-net操纵杆因为固件错误导致轮椅忽略中立设置并意外移动的问题。此情况在固件版本2.6中得到了纠正,但在版本2.3及更低版本中仍然存在。 使用受影响产品可能会造成严重的不良健康后果,包括慢性疼痛、活动能力和功能独立性进一步降低、脑震荡后综合征、逐渐恶化需要进行手术的感染、长期住院和死亡。 据报有一人受伤,没有与此问题有关的死亡报告。 召回措施:2025年7月10日,mo-Vis BVBA向所有受影响的客户发送了一封紧急医疗器械召回通知,建议采取以下措施:
(美国FDA网站)
澳大利亚TGA发布关于Olympus公司因说明书更新召回支气管镜的警示信息
发布日期:2025年9月16日 召回产品:Olympus纤维支气管镜和支气管镜 召回原因: Olympus在调查了治疗性支气管镜检查期间支气管内燃烧的投诉后,于2023年发布了产品纠正和安全警报。 自 2023 年采取纠正措施后,Olympus又对兼容支气管镜与激光、氩等离子体凝固及高频治疗设备联合使用的情况进行了进一步评估。通过这些调查,Olympus认定有必要对使用说明书 (IFU) 进行额外更新,以进一步阐明支气管镜在与这些设备联合使用时的安全性与有效性。此次纠正措施取代了 2023 年提供的使用说明书补充内容。 如果发生支气管内燃烧,患者可能会遭受气道或肺部的严重内部烧伤,这可能导致需要额外的医疗干预、延长操作时间、延长住院或重症监护治疗,甚至导致死亡。燃烧还可能导致设备部件损坏或断裂,这些部件可能会对患者造成伤害,意外残留在体内,或需要取出甚至手术移除。 召回措施: 客户应: -检查受影响设备的库存; -审查更新的使用说明书并丢弃任何以前的使用说明书; -对于已停产的产品,请将带有更新内容的客户通知函副本与当前的IFU一并保存。 (澳大利亚TGA网站)
|
|