|
医疗器械警戒快讯 2025年第11期(总第225期)
发布日期:2025-12-02
医疗器械警戒快讯
(总第225期) 内容提要 澳大利亚TGA发布关于Ypsomed公司胰岛素泵Mylife CamAPS FX应用程序兼容性问题的警示信息 美国FDA发布关于B Braun Medical公司因管路进气风险召回血液透析管路套装的警示信息 美国FDA发布关于Intersurgical公司因电池液泄露及无法启动等问题召回 i-View电子喉镜的警示信息 美国FDA发布关于Siemens Healthineers公司因氦气泄露风险召回3 Tesla MRI系统的警示信息 澳大利亚TGA发布关于Philips公司因组件脱落风险召回Incisive CT系统的警示信息
澳大利亚TGA发布关于Ypsomed公司胰岛素泵Mylife CamAPS FX应用程序兼容性问题的警示信息
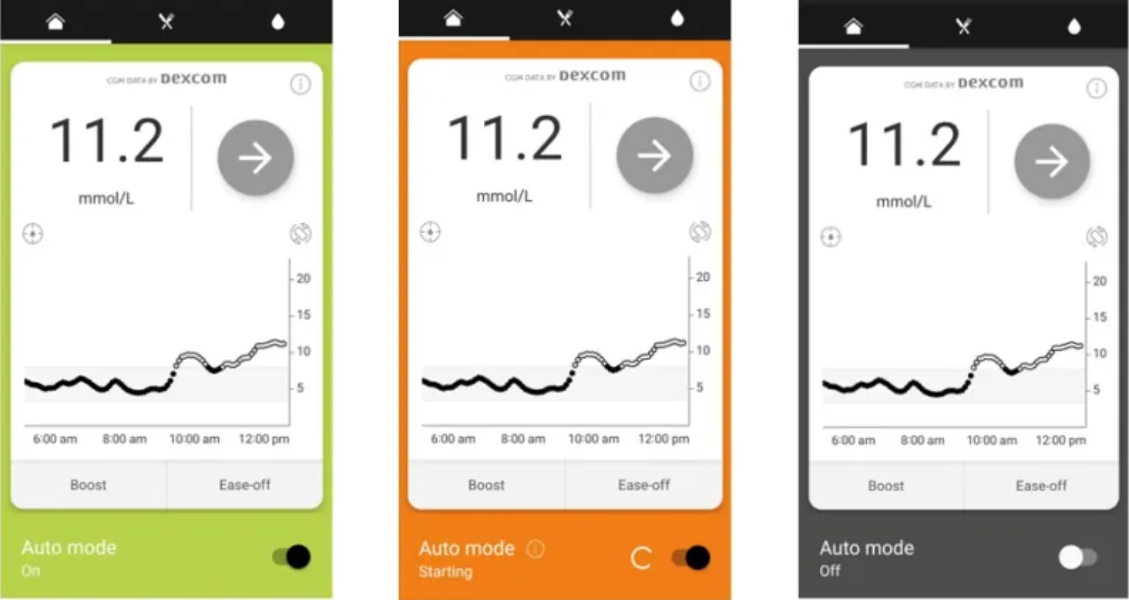
发布日期:2025年10月30日 警示类型:产品纠正 警示产品:Ypsomed公司胰岛素泵Mylife CamAPS FX应用程序 Dexcom ONE+连续血糖监测系统(Dexcom ONE+)是一种血糖监测系统,适用于连续测量2岁及以上人群(包括孕妇)间质液中的葡萄糖。Dexcom ONE+通过Dexcom ONE+接收器或使用与Dexcom ONE+ CGM App(Android、iOS)兼容的智能设备显示血糖读数、趋势、警告和通知。Dexcom ONE+还有助于检测高血糖和低血糖发作,促进急性和长期治疗调整。Dexcom ONE+旨在供患者在家中和医疗机构中使用。 警示原因: Ypsomed Australia提醒用户在使用Mylife CamAPS FX应用程序时确保使用兼容的智能设备和操作系统(OS)。该产品的使用说明(IFU)没有对智能设备和操作系统兼容性提供足够的明确说明。 首次发布时,最近的Android OS或Apple iOS更新可能与首次发布时的Mylife CamAPS FX应用程序和/或胰岛素泵不兼容。如果智能设备或操作系统在与应用程序不兼容的情况下进行了更新,则应用程序可能会停止正常工作。 该问题可能: 如果发生这种情况,应用程序将通过切换到预设的基础泵速来恢复其安全默认值。主屏幕背景颜色将从绿色(自动模式“开”)变为橙色(自动模式“尝试”)或灰色(自动模式“关闭”)。见下图。 图 Mylife CamAPS FX应用程序:自动模式开启、自动模式尝试、自动模式关闭 受影响的应用程序版本:Android 1.4(189)和iOS version 1.4(192)以及所有之前的版本。 控制措施: 在CamAPS FX应用程序中查看更新后的关于智能设备操作系统兼容性的IFU。 关闭手机操作系统的自动更新。查询制造商网站确认与操作系统兼容后再更新(网站:https://camdiab.com/notifications)。 如果使用不兼容的智能设备操作系统,您的应用程序系统可能会恢复到手动模式(灰色或橙色屏幕)并提供预设的基本速率。您仍然可以通过应用程序为您的饮食管理推注速效胰岛素剂量,并查看葡萄糖传感器数据。 (澳大利亚TGA网站)
美国FDA发布关于B Braun Medical公司因管路进气风险召回血液透析管路套装的警示信息
发布日期:2025年11月19日 召回级别:此次召回涉及更新相关器械的使用说明,而非从使用单位或销售机构撤回设备。美国食品药品监督管理局(FDA)已将此次召回识别为最严重的类型。如果不加以纠正,继续使用该器械可能会导致严重伤害或死亡。 召回产品:Dialog+ Streamline血液透析管路套装 与Dialog+ 血液透析系统联合使用的Streamline血液透析管路,适用于在医生处方下的血液透析。本次召回涉及产品型号、UDI及产品编号参见FDA网站: https://www.fda.gov/medical-devices/medical-device-recalls-and-early-alerts/alert-update-use-instructions-b-braun-hemodialysis-blood-tubing-set 相关问题: B Braun Medical Inc.发现,因为制造问题部分批次的Dialog+ Streamline血液透析管路套装中,动脉回路和静脉回路的患者连接器破损,可能导致管路内出现微气泡并触发管内进气警报。这种破损会使空气进入体外循环回路,并可能导致液体泄漏;如更换管路,会导致治疗延迟;如果因为治疗原因暂时无法更换管路,可能会导致治疗效率降低或效果不充分;当空气进入管路时,体外循环回路中的血液将无法回流而必须被排弃,将导致患者中度失血;在某些情况下,中度失血可能导致患者状况恶化,需要立即治疗;管路的破口会破坏无菌状态,可能导致患者感染而需要进一步治疗干预;对于危重患者,失血或感染是可能危及生命的严重不良事件;如果空气进入患者体内循环系统,还可能导致空气栓塞。 截至2025年9月30日,B Braun Medical Inc.尚未收到与此问题相关的严重伤害或死亡报告。 召回措施: 9月30日,B Braun Medical Inc.向所有受影响用户发送了一封信,建议采取以下措施:尽量使用未受影响的SL-2010M2096套装,或其他透析管路。如果没有可替代管路而必须使用受影响产品治疗患者,用户应采取额外措施以减轻可能造成的患者伤害:确保完全按照产品使用说明(IFU)操作,特别是应遵循患者连接器安全连接说明,以降低漏气的概率;在治疗期间加强对管路的肉眼检查,如果发现漏气,请按照产品IFU重新固定或紧固连接;如果重新固定或紧固连接仍无法解决问题,应停止透析并夹闭管路,在临床允许的时间内尽早更换管路;如果需要在存在微小气泡的情况下使用管路,应避免高流量模式。 (美国FDA网站)
美国FDA发布关于Intersurgical公司因电池液泄露及无法启动等问题召回 i-View电子喉镜的警示信息
发布日期:2025年11月21日 召回级别:此次召回涉及从使用或销售的地方移除某些设备。FDA已将此次召回确定为最严重的类型。如果您继续使用此设备而不进行纠正,可能会导致严重伤害或死亡。 召回产品: i-View 电子喉镜 型号:8008000 批号/序列号:1240555和1240793 产品用途:i-View电子喉镜适用于直接和间接观察喉部,以方便成人经口气管插管。 召回原因:Intersurgical公司正在召回i-View电子喉镜,原因是该设备无法启动、电池液体泄漏以及屏幕变为空白。 使用受影响的产品可能会导致严重的不良健康后果,包括创伤、血氧下降、缺氧、口咽损伤、胃内容物吸入以及死亡。 截至2025年6月20日,Intersurgical尚未报告与此问题相关的任何严重伤害或死亡。 召回措施: 立即停止使用并隔离任何受影响的库存。如果受影响的设备已进一步分发,请通知客户。 2025年6月17日,Intersurgical公司向所有受影响的客户发送了紧急医疗器械召回通知,建议采取以下行动: 立即停止使用并隔离任何受影响的库存。 立即联系所有客户,告知他们召回情况,并让他们退还未偿还的召回库存。 (美国FDA网站)
美国FDA发布关于Siemens Healthineers公司因氦气泄露风险召回3 Tesla MRI系统的警示信息
发布日期:2025年11月19日 召回级别:此次召回涉及纠正特定器械但不包括将其从使用或销售的地方移除。FDA已将此次召回确定为最严重的类型。如果您继续使用此设备而不进行纠正,可能会导致严重伤害或死亡。 召回产品:见下图
产品用途:受影响的3Tesla MRI系统包括磁共振诊断设备(MRDD)和结合MRDD和正电子发射断层扫描(PET)的mMR系统。这些设备显示头部、身体或四肢的内部结构和/或功能,并可由受过适当培训的卫生保健专业人员使用,以帮助检测、定位和诊断疾病和障碍。 召回原因:Siemens Healthineers 正在对其3Tesla MRI系统进行纠正,因为磁体排放系统中可能已经形成或可能形成冰堵。在超导状态突然丧失(即磁体猝灭)时,氦气可能无法通过指定的排放路径排出,导致氦气容纳系统内部压力升高。 这种压力升高可能使氦气容纳系统破裂,从而可能导致大量氦气泄漏进入扫描室。氦气容纳系统的破裂也可能表现为爆炸,在 MRI 室内造成过压,并猛烈喷出碎片。 使用受影响的产品可能会导致严重的不良健康后果,包括冻伤、窒息、外伤,甚至死亡。 召回措施: 如果主机电脑上出现错误信息 “Magnet Supervision: The average heater power is above the alarm threshold. Please contact Siemens Healthineers Service”(磁体监控:平均加热器功率高于报警阈值。请联系西门子医疗服务),则不能继续进行扫描。请立即遵循额外的安全措施。 2025 年 8 月 27 日,Siemens Healthineers 向所有受影响的客户发送了《紧急医疗器械纠正通知》信,建议采取以下措施: 如果主机电脑出现上述错误信息,请执行以下安全操作: 在完成检查之前,你仍可继续使用该系统。 (美国FDA网站)
澳大利亚TGA发布关于Philips公司因组件脱落风险召回Incisive CT系统的警示信息
发布日期:2025年11月13日 召回产品:Philips Incisive CT、CT 3500 和 CT 5300 系统 召回原因: Philips已发现,如果在更换后没有将旋转扫描架上的球管热交换器(tube heat exchanger)的螺丝拧紧,Philips Incisive CT、CT 3500 和 CT 5300 系统可能会出现问题。该组件可能会脱落,并在旋转过程中与 Philips CT 系统内部的其他组件接触。由于与热交换器接触,其他组件可能会受到损坏。 如果出现此问题,设备会发出巨大的噪声,并且系统会自动关闭。 如果发生以下顺序事件,机架右上方的外罩可能会破裂: 破裂的机架右上外罩可能会形成一个缝隙,使受损组件的碎片以较低的动能被甩出,并落在机架的右侧。 召回措施: 客户应: -通过位于机架左后角的设备标识符、型号(REF)和系统序列号(SN)识别受影响的系统。 -继续按照预期用途使用他们的系统,扫描时不要呆在扫描室里。 Philips将联系用户,安排现场服务工程师(FSE)访问每个客户现场,检查管式换热器螺钉,必要时纠正松动的螺钉(参考FCO72800842)。 (澳大利亚TGA网站)
|
|